
撰文丨王聪豪资随配
编辑丨王多鱼
排版丨水成文
2025 年 9 月 24 日,在第十届 CAR-TCR 峰会上,Aera Therapeutics展示了其候选疗法AERA-109的临床前数据,这是一款in vivoCAR-T 细胞疗法,旨在治疗多种B 细胞介导的自身免疫疾病(例如系统性红斑狼疮)。
结果显示,在人源化小鼠模型和非人灵长类动物中,经过 AERA-109 治疗后,血液和组织中的 B 细胞被深度耗竭。Aera 公司计划在 2026 年年中推进 AERA-109 进入临床开发阶段。
AERA-109 利用专有的靶向脂质纳米颗粒(tLNP)递送平台和CAR-T技术,直接在体内靶向重编程 CD8+ T 细胞,为严重自身免疫疾病提供了一种潜在疗法,具有更高的精准度和更好的安全性。

Aera Therapeutics由 CRISPR 基因编辑先驱张锋教授等人创立,该公司于 2023 年宣布完成 1.93 亿美元融资并正式亮相。创始团队还包括 RNAi 疗法巨头Alnylam公司前高管Akin Akinc和前创始 CEOJohn Maraganore。
基因药物有望在广泛的治疗应用中彻底改变人类疾病的治疗方式。然而豪资随配,基因药物的广泛应用在很大程度上仍受限于现有的递送技术。Aera Therapeutics的愿景是释放基因药物潜力,彻底改变人类健康。

Aera Therapeutics的创立,源自张锋实验室 2021 年发表的一篇Science论文。

在这篇论文中,张锋团队发现了人体中的一种逆转录病毒样蛋白——PEG10,其能够与自身的 mRNA 结合并在其周围形成球型保护囊。张锋团队将其改造设计后用来包装和递送 RNA,例如,其能够将 CRISPR-Cas9 基因编辑系统递送到小鼠和人类细胞并成功编辑目标基因。更重要的是,该递送系统是利用人类内源性蛋白质组分自组装为病毒样颗粒,与其他递送载体相比,所引起的免疫反应更少,更具安全性。
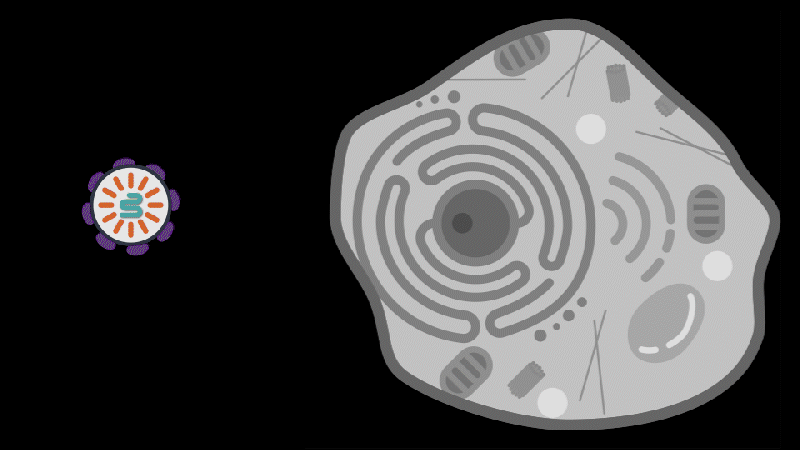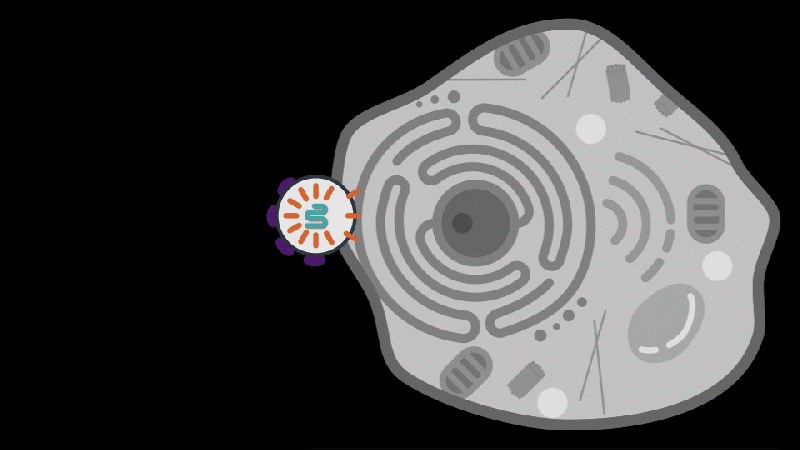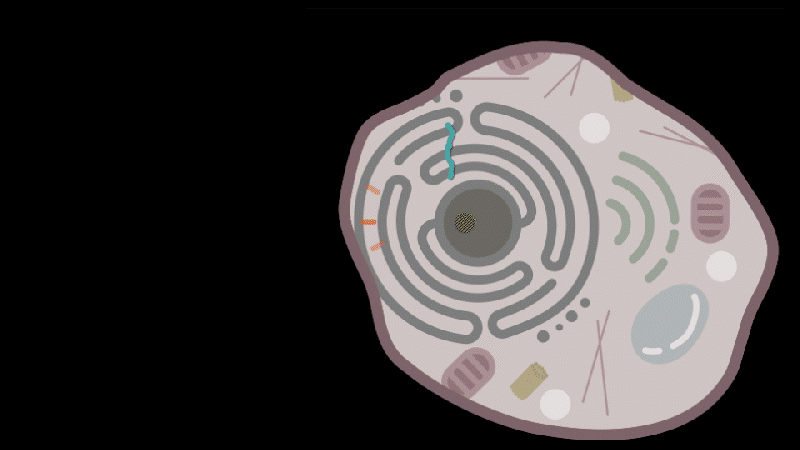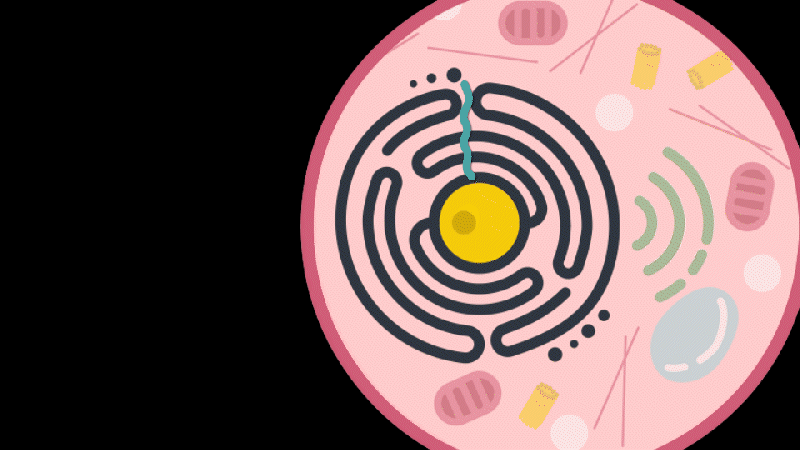
Aera Therapeutics在上述研究的基础上,推出了名为蛋白纳米颗粒(Protein Nanoparticles,PNP)的新型递送平台,旨在利用人类内源性蛋白质,补充现有的病毒载体和脂质纳米颗粒(LNP),进一步释放基因疗法的潜力。
多样化递送平台
目前,Aera Therapeutics拥有三个专有递送平台——靶向脂质纳米颗粒(tLNP)、抗体寡核苷酸偶联物(AOC)、蛋白纳米颗粒(PNP)。

靶向脂质纳米颗粒(tLNP):LNP 是当今基因药物中使用最广泛的递送系统之一,主要用于肝脏递送和疫苗应用。Aera 公司的 tLNP 递送平台,基于专有的可电离脂质,专门构建用于靶向肝脏以外的其他细胞类型和组织豪资随配,以实现更多的治疗应用。
抗体寡核苷酸偶联物(AOC):AOC 是将抗体的靶向能力与寡核苷酸(短 DNA 或 RNA 链)的可编程功能相结合。AOC 的关键组成部分包括用于靶向特定细胞或组织类型的抗体或抗体片段、携带基因药物的寡核苷酸,以及用于保持抗体功能和寡核苷酸活性的连接子。Aera 公司的 AOC 平台旨在将抗体的用途从传统的免疫学或肿瘤学扩展到其他领域,例如心脏或骨骼肌组织。
蛋白质纳米颗粒(PNP):这是一种潜在的颠覆性递送平台,可更广泛地解决基因药物的递送问题。PNP 可基于多种蛋白质进行设计,并能携带多种货物。该平台结合了蛋白质设计与工程力量以及全合成、无细胞系统的模块化、可扩展性和可制造性。Aera 公司的 PNP 在未靶向时具有更长的循环半衰期,这为通过整合特定的细胞和组织靶向配体实现模块化靶向性提供了机会。
研发管线
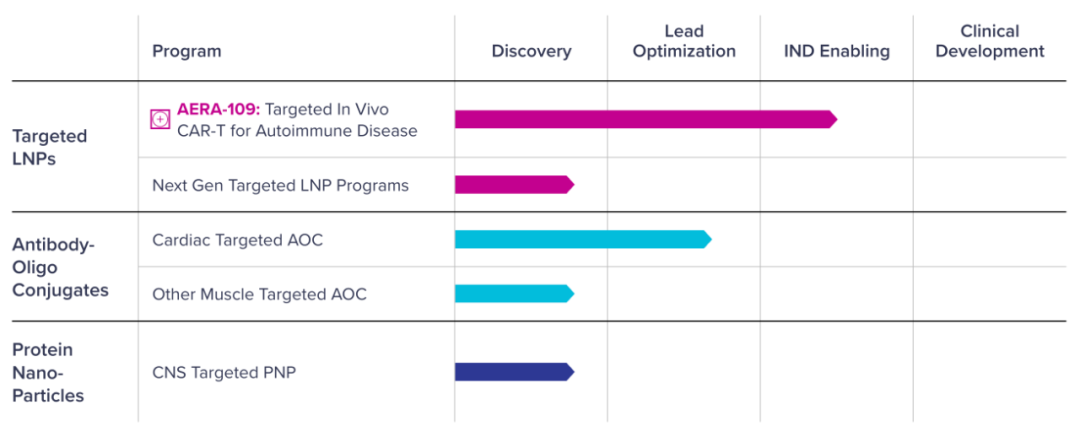
临床前数据
CAR-T 细胞疗法已彻底改变了 B 细胞驱动的血液类恶性肿瘤的治疗方式,目前已有多种体外 CAR-T 细胞疗法获得美国 FDA 批准上市。而最近,体外 CAR-T 细胞疗法在多种自身免疫疾病中也展现出治愈的希望。然而,体外 CAR-T 细胞的复杂的制造过程、需要淋巴细胞耗竭预处理以及细胞因子释放综合征(CRS)的风险限制了其在非恶性疾病中的应用。
为了克服这些挑战,Aera 公司开发了一种靶向脂质纳米颗粒(tLNP)平台,该平台能够将编码 CAR 的 mRNA 递送至体内靶向 CD8+ T 细胞,从而无需预处理即可在体内原位生成 CAR-T 细胞。体外生成的 CAR-T 细胞在输注到患者体内后,CAR-T 细胞持久存在,会导致长期 B 细胞缺乏,而体内 CAR-T 细胞疗法,是在体内短暂生成 CAR-T 细胞以实现“免疫重置”。
实验结果显示,在 CD34+ 人源化小鼠中,采用两剂方案进行体内 tLNP 给药,可导致剂量依赖性的 CAR-T 细胞生成、向活化和记忆 T 细胞状态的表型转变,以及在血液和组织中 CAR-T 细胞介导的 B 细胞耗竭。在非人灵长类动物(NHP)中,采用两剂方案以 0.3 毫克/千克的剂量通过 tLNP 递送的替代抗 CD20 CAR mRNA,诱导了短暂的 CD8+ CAR-T 细胞生成、CD8+ T 细胞的扩增以及与激活和记忆形成一致的表型变化。这导致血液、脾脏和骨髓中的 B 细胞几乎完全清除。
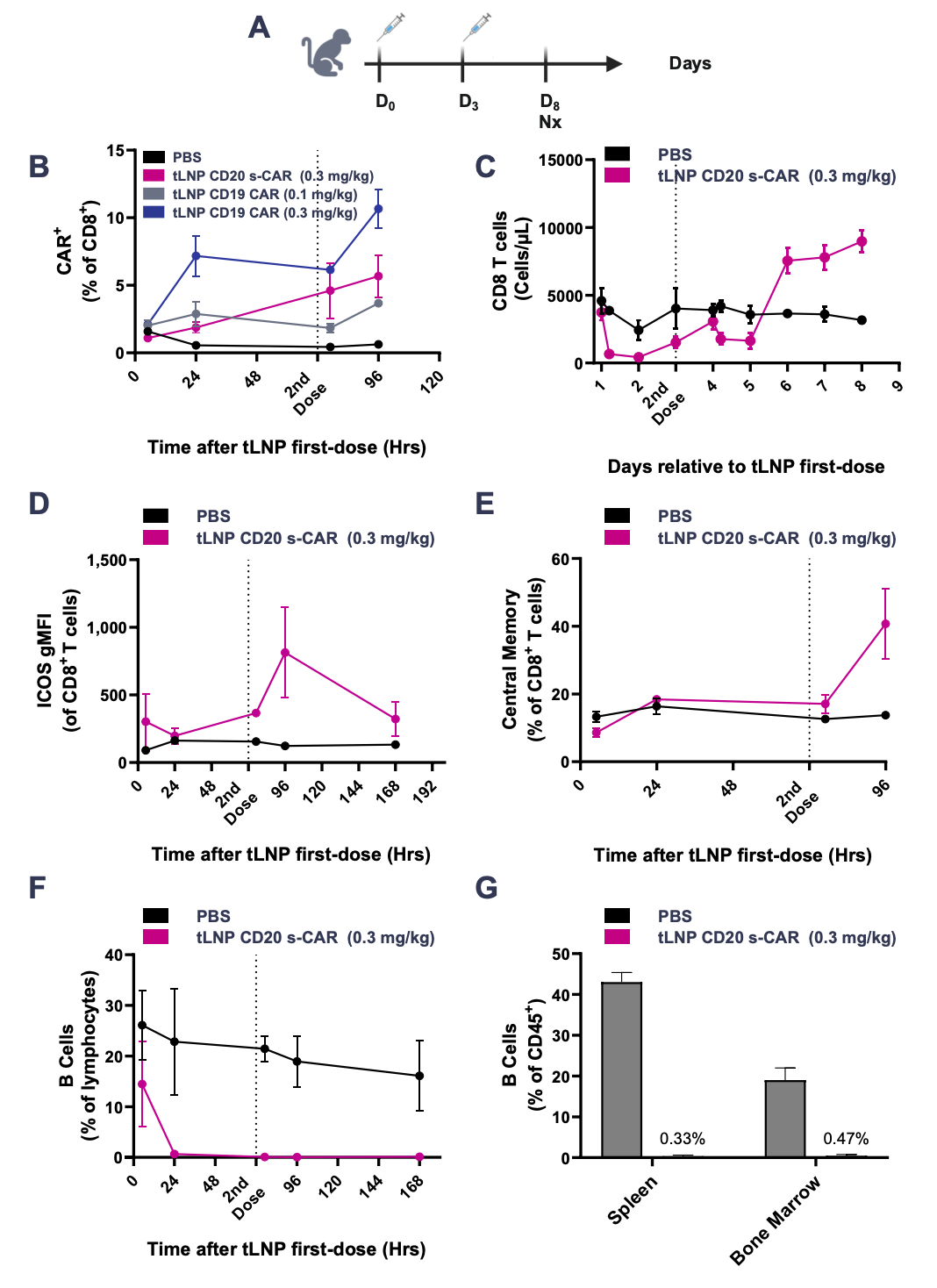
在非人灵长类动物模型中,tLNP 递送 CAR mRNA,可实现强大的 B 细胞耗竭
该疗法耐受性良好,未观察到显著的临床表现,血液学或血清化学参数也未发生变化。这些结果表明,通过 tLNP 递送编码 B 细胞靶向 CAR 的 mRNA,有可能成为一种高效、无需预处理的体内治疗 B 细胞介导的自身免疫性疾病的方法。
Aera 公司 CEOAkin Akinc博士表示:将 AERA-109 选定为公司首个候选药物,标志着 Aera 取得了重大进展,也是公司以递送为先、致力于大幅拓展基因药物应用范围的理念的有力证明。通过在体内生成具有精准组织靶向性的 CAR-T 细胞,AERA-109 有望解决传统体外细胞疗法在生产、储存和运输,以及安全性和可扩展性方面的诸多挑战。公司对在非人灵长类动物身上观察到的深度 B 细胞耗竭现象感到非常鼓舞,期待在 2026 年年中将这一项目推进到临床阶段。
https://aeratx.com/
https://science.sciencemag.org/content/373/6557/882
天宇优配提示:文章来自网络,不代表本站观点。






